0
发表咨询在线!

时间:2019-05-22 10:27:18 所属分类:药学 浏览量: 144
摘 要 研究了木兰花碱(magnoflorine,MAG)的荧光光谱和吸收光谱特征,考察了 pH 值等环境因素对荧光和吸光的影响,探讨了光谱性质与分子结构的关系。木兰花碱水溶液的三维荧光图谱中呈现 3 个荧光峰,激发波长 ex 为 230、275 和 315 nm,发射波长 em 均为 4
摘 要 研究了木兰花碱(magnoflorine,MAG)的荧光光谱和吸收光谱特征,考察了 pH 值等环境因素对荧光和吸光的影响,探讨了光谱性质与分子结构的关系。木兰花碱水溶液的三维荧光图谱中呈现 3 个荧光峰,激发波长 λex 为 230、275 和 315 nm,发射波长 λem 均为 420 nm。随溶液 pH 值升高,激发光谱中的荧光峰红移并出现等荧光点,吸收光谱中的吸收峰红移并形成等色点,表明木兰花碱分子中的 1 个羟基发生了质子电离,用 pH 值-吸光法测得电离常数 pKa = 4.77。以 L-色氨酸为参比,测得木兰花碱水溶液的荧光量子产率 Y = 0.19。青风藤等多种中药材的三维荧光图谱中呈现木兰花碱的特征荧光峰,λex/λem = 315 nm/420 nm 处的荧光峰不受共存组分的影响,且荧光强度稳定,据此建立了中药青风藤中木兰花碱的荧光分析新方法。在 0.04~1.25 μg/mL 范围内,体系荧光强度 IF与木兰花碱浓度 c 呈线性关系,回归方程为:IF = 6146.8c + 24.4(R = 0.999, n = 11),检出限 0.52 ng/mL。采用本方法测得青风藤对照药材中 MAG 的含量为 0.63%,加标回收率为 101.2%~102.7%。LC-MS/MS 法测定结果为 0.61%,与荧光法基本一致。本方法简便快速,结果可靠,有良好的实际应用价值。
关键词 木兰花碱; 青风藤;中药;三维荧光;荧光分析
1 引 言
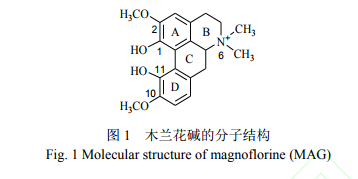
木兰花碱(又称木兰碱,Magnoflorine,MAG,图 1)属于阿朴菲类生物碱(Aporphine alkaloids) [1],广泛存在于防己科、马兜铃科等药用植物中[2~4],具有抗氧化[3,5]、膜保护[6]、降血糖[7, 8]和抗遗忘[9,10] 等药理作用,但目前木兰花碱尚未被收录入中国药典或作为药品标准。关于药用植物和生物样品中木兰花碱的分析方法,主要包括色谱法[11,12]、毛细管电泳法[13,14]和液相色谱-串联质谱(LC-MS/MS)法[15],迄今尚未见关于木兰花碱荧光性质及荧光分析方法的研究报道。
荧光分析法具有灵敏度高、选择性好、简便快速、环境友好等优点,在生化分析和化学药物分析中应用广泛。但在中药分析中,由于样品所含成分的复杂性以及中药成分荧光光谱数据的缺乏,荧光分析法的应用尚不广泛。目前,中国药典中收录的中药分析方法主要是色谱等方法,荧光法未被用于中药成分的定量分析。用荧光法测定中药成分的含量,难点在于如何避免共存组分的干扰。文献报道的中药荧光分析方法可大致分为两类:一是常规的荧光分析法,基于被测组分与干扰组分在荧光波长和强度上的差异,实现快速分析[16, 17];二是采用三维荧光法结合化学计量学方法[18,19],利用三维荧光光谱信息,借助数学统计分离程序,实现复杂样品中荧光性质相近的药效成分的计算分析[20,21]。常规方法简便快速,便于应用;三维荧光结合化学计量学方法可以解决某些常规方法难以解决的问题,扩展了荧光法的应用范围。中药成分种类繁多、数量庞大,开展中药成分荧光性质的研究是发展中药荧光分析法的关键。本研究组在研究生物碱类化合物的荧光性质时,发现木兰花碱有强荧光,其三维荧光图谱有很好的特征性。将木兰花碱标准品的三维荧光图谱与本实验室前期得到的数百种中药对照药材的三维荧光图谱进行对比,发现青风藤等多种中药材的三维荧光图谱中呈现木兰花碱的特征荧光峰,由此推测这些中药材中可能含有木兰花碱,因此,可望将木兰花碱的荧光性质用于中药分析。本研究对木兰花碱和青风藤的荧光性质进行了详细考察,建立了青风藤中木兰花碱的荧光分析方法,并利用液相色谱-串联质谱法(LC-MS/MS)对本方法进行了验证。
2 实验部分
2.1 仪器与试剂
F-7000 荧光分光光度计(日本 Hitachi 公司);UV-2501PC 紫外-可见分光光度计(日本 Shimadzu 公司);LC-TRIPLE QUAD 5500 液相色谱-串联质谱仪(美国 AB SCIEX 公司);Milli-Q 型超纯水机(美国 Millipore 公司);828 型 pH/ISE 测试仪(芬兰 Orion 公司);十万分之一分析天平(日本 Shimadzu 公司)。木兰花碱(CAS: 2141-9-5,HPLC 级,纯度>98%,成都瑞芬思生物科技有限公司)溶液:称取木兰花碱对照品 2.08 mg,用水溶解并定容至 25ml,配制成 83.2 μg/mL 木兰花碱标准溶液,低温保存,备用,使用时适当稀释;青风藤对照药材(1251-0301,防己科植物青藤 Sinomenium acutum ( Thunb.) Rehd. et Wils.(Qingfengteng)的干燥藤茎,中国食品药品检定研究院);甲醇(色谱纯,美国 Tedia 公司);甲酸(色谱纯,美国 Dikma 公司),经检验无荧光;缓冲溶液:将含磷酸、乙酸和硼酸的混合溶液(均为 0.20 mol/L)与 NaOH 溶液(1.0 mol/L)以一定比例混合,用于调节 pH 值;L-色氨酸(L-Tryptophan,天津市光复精细化工研究所);实验用水为二次去离子水,经检测无荧光。
2.2 实验方法
2.2.1 pH 值对吸光和荧光的影响 在一系列 10 mL 容量瓶中,分别加入适量木兰花碱溶液,以缓冲溶液控制 pH 值,以水定容,分别扫描各溶液的吸收光谱或荧光光谱,并精确测量 pH 值,荧光测定时选择激发和发射狭缝(Slit)为 5.0 nm,光电倍增管负高压(PMT)为 700 V。
2.2.2 荧光量子产率的测量 在 25 mL 容量瓶中分别加入适量 L-色氨酸溶液和木兰花碱溶液(控制溶液浓度,使激发波长下的吸光度 A≥0.05),以水定容。测量吸收光谱和荧光光谱,测量激发波长处的吸光度和积分荧光强度。以 L-色氨酸为参比(280 nm 处的荧光量子产率 0.14),计算待测物质的荧光量子产率[22]。
2.2.3 青风藤样品提取液的制备 经不同比例的甲醇-水提取溶剂的对比实验,确定提取溶剂中甲醇的体积分数为60%。称取青风藤对照药材粉末0.025 g,以提取溶剂溶解并定容至50 mL,超声振荡30 min,静置过夜,经 0.45 μm 微孔滤膜过滤,得浓度为 500 μg/mL 的提取液。
2.2.4 色谱条件 Agilent Eclipse XDB-C18 色谱柱(50 mm ×4.6 mm, 1.8 μm);流动相:甲醇- 0.01%甲酸(60:40,V/V);流速 0.3 mL/ min;柱温 40 ℃;进样量 4 μL。
2.2.5 质谱条件 离子源为电喷雾电离源 (ESI);气帘气(CUR): 275 kPa;离子化电压 5.5 kV;离子源温度 500 ℃;喷雾气(GAS1): 345 kPa;辅助加热气(GAS2): 345 kPa;正离子全扫描方式;采用多离子反应监测(MRM)模式定量分析。木兰花碱的质谱检测参数见表 1,与文献[23]中的参数基本一致。
3 结果与讨论
3.1 木兰花碱水溶液的三维荧光图谱
在酸性条件下,木兰花碱水溶液在发射波长(λem)420 nm 处呈现一组荧光峰,激发波长(λex)分别为 230 nm、270 nm 和 300 nm(图 2A); pH 值为近中性时(图 2B),λem基本不变,λex 和荧光峰形有所变化,图 2A 中 300 nm 激发峰红移至 315 nm;pH 值升高至碱性时(图 2C),荧光波长基本不变。上述结果表明,在溶液 pH 值由酸性到近中性的过程中,木兰花碱的分子结构发生了变化,其分子中的羟基可能发生了质子电离[24]。
图 2 木兰花碱(0.166 μg/ml; CH3OH:H2O=1:1(V/V))在不同 pH 值值(A. 2.0 ; B. 5.8 ; C. 10.0)时的三维荧光图谱(等高线步长:100) Fig. 2 Three dimensional fluorescence spectra (counter interval: 100) of MAG solution (0.166 μg/ml, CH3OH:H2O=1:1 (V/V)) with different pH 值 values (A. 2.0; B. 5.8; C. 10.0) 木兰花碱三维荧光图谱(图 2)有较强的荧光强度和很好的特征性。本实验室曾研究过数百种中药材的三维荧光图谱[25],但因缺乏中药成分荧光性质基础资料,其中大多数难以判断荧光峰的归属。将图 2 与这些中药材的三维荧光图谱进行对比,发现青风藤、川乌、黄连、威灵仙、关黄柏、酸枣仁、淫羊藿等中药材的三维荧光图谱中呈现木兰花碱的荧光峰。因此,木兰花碱的荧光性质可望用于这些中药材的鉴别与其中木兰花碱的分析测定。
3.2 木兰花碱荧光的影响因素
测定了木兰花碱在不同 pH 值条件下的二维荧光光谱(图 3A)。在酸性条件下(pH 1.7~5.9),随 pH 值升高,激发光谱中 270 nm 处的荧光峰减弱并红移至 275 nm,230 和 300 nm 处的荧光峰升高并分别红移至 235 和 315 nm,在 252 和 297 nm 出现等荧光点;发射光谱中 420 nm 处的荧光峰波长不变,但强度减弱。在近中性及碱性条件下(pH 6.4~14.0),荧光波长和强度均基本不变。荧光强度与 pH 值之间的关系如图 3B 所示。根据不同 pH 值下木兰花碱的荧光光谱变化推断,在 pH 1.7~14.0 之间,木兰花碱发生了羟基质子电离。激发光谱中等荧光点的出现表明,在 pH 值变化过程中,木兰花碱存在两种荧光型体的转化[24],一种是在酸性条件下的分子型体,另一种是在近中性和碱性条件下的离子型体,两种型体的荧光激发波长不同,发射波长相同,均为 420 nm。木兰花碱分子结构中有 2 个羟基,但只有 1 个羟基质子电离。从分子结构看,木兰花碱 B 环上季铵 N 原子带正电荷,对相邻 A 环的 π-电子体系有吸引作用,使得 C1 位上的羟基较易电离出质子。文献[26]计算得到 C1 位‒OH 键能(88.7 kcal/mol)低于 C11位‒OH 键能(90.9 kcal/mol)。因此,推测应该是 C1 位羟基质子电离。质子电离后产生的氧负离子与 A 环共轭,增大了 A 环的电子云密度,导致激发波长(吸收波长)红移。另一方面,氧负离子可能与空间距离较近的 D 环 C11 位羟基形成分子内氢键[27],导致 C11 位羟基质子难以电离。
图 3 (A)不同 pH 值值的木兰花碱水溶液(0.458 μg/mL; 10.0%(V/V)甲醇)的荧光光谱(λex / λem = 270 nm/420 nm);(B)荧光强度与 pH 值的关系(a: 270 nm / 420 nm; b: 315 nm / 420 nm) Fig.3 (A) Fluorescence spectra (λex / λem = 270 nm / 420 nm) of MAG aqueous solutions (0.458 μg/mL; 10.0% (V/V) methanol) with different pH values; (B) Relationship between fluorescence intensity and pH value (a: 270 nm / 420 nm; b: 315 nm / 420 nm) 甲醇和水是提取及测定中药荧光成分时的常用溶剂。本实验表明,在水-甲醇体系中,随着甲醇体积分数增大,木兰花碱的 λem逐步蓝移;在甲醇中 λem=375 nm,荧光有所增强。从实验成本和环境保护等方面考虑,应选择在近中性水溶液中测定木兰花碱的荧光。有序介质常对物质的荧光有敏化作用。实验结果表明, 0.02 mol/L 十二烷基硫酸钠(SDS)和溴化十六烷基三甲铵(CTAB)对木兰花碱水溶液的荧光基本无影响。因此,在建立木兰花碱的荧光分析方法时,可直接利用木兰花碱的内源荧光。在日内和日间(1,3 和 5 d)分别测量 9 份相同浓度的木兰花碱水溶液的荧光强度,相对标准偏差 RSD 分别为 0.5%和 1.2%,表明木兰花碱的荧光稳定。综上,木兰花碱在近中性水溶液中有稳定的强荧光,适宜用于分析测定。
3.3 木兰花碱的吸收光谱与电离常数
为了验证上述木兰花碱荧光光谱随 pH 值变化的分子机理,测定了木兰花碱水溶液在不同 pH 值下的吸收光谱(理论上,荧光激发光谱与吸收光谱的图形相似,随 pH 值变化的趋势相同),结果见图 4A。在酸性条件下,木兰花碱在 250~380 nm 波长范围内有 2 个吸收峰,吸收波长分别为 268 和 300 nm。随 pH 值升高,268 nm 处的吸收峰红移至 275 nm,吸光度降低;同时,300 nm 吸收峰红移至 316 nm,吸光度升高,在 254 nm 和 302 nm 形成等色点;pH > 6 后,吸收光谱不再随 pH 值的升高而变化。各光谱曲线在 320 nm 处的吸光度 A 与 pH 值的关系呈 S 形曲线(图 4B)。在 240~350 nm 范围,图 4 中的吸收光谱与图 3 中的荧光激发光谱形状相似,变化趋势相同。
图 4 (A)不同 pH 值的木兰花碱溶液(4.58 μg/mL, 10.0%(V/V)甲醇)的吸收光谱;(B)吸光度与 pH 值的关系(λ = 320 nm) Fig. 4 (A) Absorption spectra of MAG solutions (4.58 μg/mL; 10.0% (V/V) methanol) with different pH 值; (B) Relationship between absorbance at 320nm and pH 值 value 图 4A 中出现等色点,表明木兰花碱在水溶液中存在两种吸光型体(也是荧光型体)的相互转化,木兰花碱发生了质子电离,表现为一元弱酸。根据图 4 中的光谱数据,可以用 pH 值-光度法测定木兰花碱羟基质子的电离常数 pKa,计算公式为: L a HL - p = pH + lg - A A K A A (1)式中,AHL表示弱酸分子全部以分子型体存在时的吸光度(如图 4B 中 pH 2.5 附近的 A 值),AL表示弱酸分子全部以离子型体存在时的吸光度(如图 4B 中 pH 7.0 附近的 A 值)。将图 4B 中位于 S 形曲线中间部分的 pH-A 数据代入式(1),计算 pKa,结果见表 2。平均值为 pKa = 4.77。
3.4 木兰花碱的荧光量子产率的测定
按照 2.2.2 方法测得木兰花碱水溶液(离子型体)的荧光量子产率为 0.19,属于强荧光物质。从分子结构(图 1)上看,木兰花碱具有强荧光物质的分子结构特征:具有大的共轭 π 键结构,图 1 中 A、 D 两个苯环形成联苯结构,共轭程度较高;具有刚性平面结构,C 环与 A、D 两环连接,增加了分子的平面性和刚性,其离子型体的 C1 位氧负离子可能与 C11 位羟基形成分子内氢键,也使分子的刚性增强;苯环上的给电子取代基(羟基和甲氧基)具有增强荧光的作用;从图 1 和荧光波长为 420 nm 可以推断,木兰花碱的最低单线电子激发态 S1 为(π,π *)型,此类跃迁几率高,荧光强度大。
3.5 中药青风藤提取液的三维荧光图谱
青风藤为防己科植物青藤和毛青藤的干燥藤茎,主治风湿痹痛、关节肿痛等症[28]。在青风藤药材中已发现逾 60 种化合物,主要包括生物碱类、脂类、甾醇类、萜类、菲类和蒽醌类等[29],其药效成分主要为吗啡烷类[30,31]和阿朴菲类[32]生物碱。虽然青风藤中的化学成分种类繁多,但其提取液的荧光光谱比较简单(图 5)。
图 5 不同 pH 值(A. 2.0 ; B. 5.8 ; C. 13.0)下青风藤提取液(50.0 μg/mL,10.0%(V/V)甲醇)的三维荧光图谱(等高线步长:200) Fig.5 3D fluorescence spectra(counter interval: 200)of Qingfengteng extracts(50.0 μg/mL, 10.0% (V/V) methanol)with different pH 值 values(A. 2.0 ; B. 5.8 ; C. 13.0)图 5 与图 2 中,位于 λem= 420 nm 的荧光峰的激发波长和光谱形状基本一致,且随 pH 值的变化基本相同,可判断为木兰花碱的荧光峰。在图 5 中,短波处(λem= 330~340 nm)的荧光峰推测为吗啡烷类生物碱,此类化合物的分子共轭程度较低,荧光波长较短。在碱性条件下(图 5C),木兰花碱荧光峰的 λem 略有红移,可能是菲类及蒽醌类化合物所致,这些化合物的分子共轭程度较高,荧光波长较长。对比图 5 和图 2 可知,如选择在中性水溶液中,激发波长为 315 nm 时测定木兰花碱的荧光,青风藤中的其它组分基本不干扰。
3.6 青风藤中木兰花碱的荧光法测定
配制一系列不同浓度的木兰花碱标准溶液,测定其荧光光谱(图 6A),荧光强度 IF(λex/λem= 315 nm/420 nm)与木兰花碱浓度在 0.04~1.25 μg/mL 范围内呈良好的线性关系(图 6B),回归方程为 IF = 6146.8c + 24.4,相关系数 R = 0.999(n = 11)。方法的检出限(D = 3sb/S,sb 为空白信号标准偏差,S 为标准曲线斜率) 为 0.52 ng/mL。
图 6 (A)不同浓度(0.04~1.25 μg/mL)木兰花碱水溶液的荧光光谱(λex/λem= 315 nm/420 nm);(B)荧光强度与浓度的关系 Fig.6 (A) Fluorescence spectra (λex/λem= 315 nm/420 nm) of MAG aqueous solutions with different concentration (0.04‒1.25 μg/mL); (B) Relationship between fluorescence intensity and concentration 在青风藤样品提取液中加入不同体积的木兰花碱标准溶液,进行加标回收实验,结果见表 3。加标回收率在 101.2%~102.7%之间。
配制 4 份不同浓度的青风藤提取液,采用本方法进行测定,测定其中木兰花碱的含量平均值为 0.63%,相对标准偏差(RSD, n = 4)为 0.1%。用本方法测定木兰花碱时,如果样品提取液中的其它组分在测量波长下也产生荧光,则会对测定产生干扰。利用 LC-MS/MS,测定了同一青风藤样品中木兰花碱的含量为 0.61%,RSD 为 2.5%(n = 3)。两种方法测定结果基本一致,表明本方法准确、可靠。
4 结论
木兰花碱水溶液可产生稳定的强荧光,可用于中药样品中木兰花碱的分析测定。本研究建立的青风藤中木兰花碱的荧光分析新方法具有简便快速、环境友好、灵敏度高、结果可靠等优点,实用性良好。本研究为中药和生化样品中木兰花碱的分析测定提供了一条新思路。
References
1 Nakano T. Pharm. Bull., 1954, 2(2): 329-334
2 Sarma D N K, Koul S, Khosa R L. J. Pharm. Sci. Res., 2009, 1(1): 26-27
3 Li C, Wang M H. Korean J. Plant Resour., 2014, 27(3): 223-228
4 Morris J S, Facchini P J. J. Biol. Chem., 2016, 291(45): 23416-23427
木兰花碱的荧光性质及其在中药分析中的应用研究相关论文期刊你还可以了解:《国际中医中药杂志》
声明:①文献来自知网、维普、万方等检索数据库,说明本文献已经发表见刊,恭喜作者.②如果您是作者且不想本平台展示文献信息,可联系学术顾问予以删除.
转载请注明来自:http://www.zazhifabiao.com/lunwen/yyws/yx/45112.html